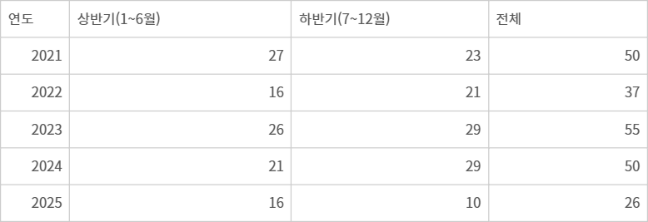
올해 상반기 미국 식품의약국(FDA)의 혁신 신약(Novel Drug) 승인 속도가 주춤했던 것으로 나타났다. 혁신 신약을 처음 승인 이후 2022년을 제외하고 매년 상반기 20건 이상을 유지해온 것과 달리, 올해 상반기 누적 승인 건수는 16건에 머물렀다.
1일 FDA에 따르면 올해 승인한 혁신 신약은 상반기 16건, 7~8월 10건으로 총 26건이다. 연도별로 보면 2021년 50건, 2022년 37건, 2023년 55건, 2024년 50건이었다.
혁신 신약은 최근 수년간 연평균 50건 안팎으로 승인되며 글로벌 제약산업의 연구개발 성과를 보여왔다. 그러나 2025년 들어 상반기 승인 건수가 16건에 그쳐 전년 동기 대비 다소 부진한 흐름을 보였다.
승인 속도 둔화는 미국의 규제·정책 환경 변화와 무관치 않다. 트럼프 행정부의 약가 인하 정책과 의약품 관세 강화 움직임이 맞물리면서 제약사들이 신약 출시 일정을 조율하고 있기 때문이다. 승인 건수 자체는 줄었지만 혁신 신약의 항체약물접합체(ADC), 희귀질환 치료제 등 고부가가치 파이프라인이 대거 포함됐다.
상반기 승인 품목을 보면 글로벌 빅파마들이 주도권을 잡았다. 애브비는 폐암 치료용 ADC '엠렐리스', 존슨앤드존슨은 면역질환 치료제 '이마비'를 허가받았다. 아스트라제네카와 다이이찌산쿄가 공동개발한 다토포타맙 데룩스테칸은 ADC로 승인받다. 이 밖에도 노바티스의 원발성 면역글로불린 A 신장병증 치료제 '반라피아', 사노피의 혈우병 치료제 '큐피리아', GSK의 항균제 '블루제파', 버텍스의 비마약성 진통제 '저나백스' 등이 승인 명단에 이름을 올렸다.
ADC·항체·희귀질환 타깃 파이프라인 비중이 커지고, 항균제·진통제 등 미충족 수요가 높은 분야의 의약품이 승인됐다.
혁신 신약 승인 품목은 국내 제약바이오 기업들에도 시사하는 바가 크다. 글로벌 신약 승인 트렌드가 합성의약품에서 바이오의약품·첨단 모달리티 중심으로 이동하는 것을 보여준다. 빅파마들은 희귀질환·항암제 영역에서도 파이프라인 다각화를 추구하고 있다.
하반기에도 고부가가치 신약·희귀질환 치료제 등 주요 후보물질들의 승인 여부가 남아 있다. BTK 억제제·마이오신 억제제·IL-5 항체 등 다양한 작용기전의 신약 다수가 승인권고 또는 심사절차에 올라 있어 승인될 수 있을지 주목된다.
송혜영 기자 hybrid@etnews.com


![에이비엘바이오 'ABL301', 최초 IGF1R 타깃 BBB셔틀 개발 의미 커 [Why 바이오]](https://newsimg.sedaily.com/2025/09/02/2GXQTXNXYF_1.jpg)
![[단독]HK이노엔, MASH 치료제 개발 전략 재검토](https://nimage.newsway.co.kr/photo/2025/09/02/20250902000008_0700.png)
![[GAM] 트럼프식 국유화? 지분 수집 또 어디 ③의약 2곳 거론](https://img.newspim.com/etc/portfolio/pc_portfolio.jpg)